PharmaWiki Sauerstoff
Eine recht hohe Affinität zu Sauerstoff besitzen die Metalle Aluminium, Eisen und Zink. Wir merken uns: Edle Metalle haben eine niedrige Affinität zu Sauerstoff, unedle Metalle dagegen eine hohe. Wenn es knifflig wird: Der Begriff der Stabilität ist fest verbunden mit dem Begriff der Affinität zu Sauerstoff.
Reaktion von Aluminium und Schwefel wie geht das? (Chemie, Naturwissenschaft, Atom)

Verbrennung von Methan. Bei einer Verbrennung reagiert der Ausgangsstoff mit Sauerstoff und als Nebenprodukt entsteht Wasser. Unser Ausgangsstoff, der verbrennt werden soll, ist ein Methanmolekül. CH 4 + 2 O 2 CO 2 + 2 H 2 O. Methan (CH 4) hat als stöchiometrische Zahl in dieser chemischen Reaktionsgleichung eine 1.Sie muss nicht geschrieben werden.
Sehr schwere Reaktionsgleichungen ausgleichen YouTube

Metalle reagieren mit Sauerstoff leicht und verständlich erklärt inkl. Übungen und Klassenarbeiten. Nie wieder schlechte Noten! Direkt zum Inhalt. Wie du die Reaktionsgleichung der Reaktion von Metallen mit Sauerstoff aufstellst. Übung. einfach. mittel. schwer. Reaktionsgleichungen: Metalle und Sauerstoff. einfach: mittel: schwer:
eqiooki.de • Chemie • Nomenklatur und Reaktionsgleichungen
Redoxreaktionen zu verstehen ist in der Mittelstufe oft nicht schwer. Lavoisier hatte eine gute Definition gefunden, die eine Redoxreaktion leicht erkennbar.
Aufstellen von Reaktionsgleichungen lernen mit Serlo!
den. Das Metall Aluminium kann hierdurch von anderen Metallen, wie Kupfer und Eisen, die im Unterricht behandelt werden, abgegrenzt werden. Die geringe Reaktivität in der Brennerflam-me kann in einen Bezug zur Verwendung von Aluminium im Alltag gestellt werden. Die SuS benötigen für diesen Versuch Vorwissen zum Thema chemische Reaktion. Sie.
Reaktionsgleichung von Maleinsäure und Ethylene Glykol? (Chemie, veresterung)

Am Beispiel der Reaktion von Aluminium und Sauerstoff Schritt 1 Elementsymbole. Stelle die Reaktionsgleichungen folgender Reaktionen auf: 1. Fluor und Lithium 2. Natrium und Schwefel 3. Magnesium und Sauerstoff 4. Bor und Chlor 5. Aluminium und Stickstoff 6. Beryllium und Stickstoff . Title: Aufstellen von Ionengleichungen Author: Lutz
Reaktionsgleichung

widerstandsfähig gegenüber Außeneinflüssen ist. Doch auch Aluminium reagiert mit dem Sauerstoff aus der. Luft. Oxidation: Al + 2e- = Al2+. Reduktion: H2O + 1/2 02 + 2e- = 2 (OH)-. Gesamtgleichung: Al + H2O + 1/2 O2 = Al (OH)2. Das entstandene Kontaktelement bildet im Unterschied zum Rost. eine luft- und wasserundurchlässige Schicht und ist.
The Best Aluminium Und Sauerstoff Reaktionsgleichung Ideas

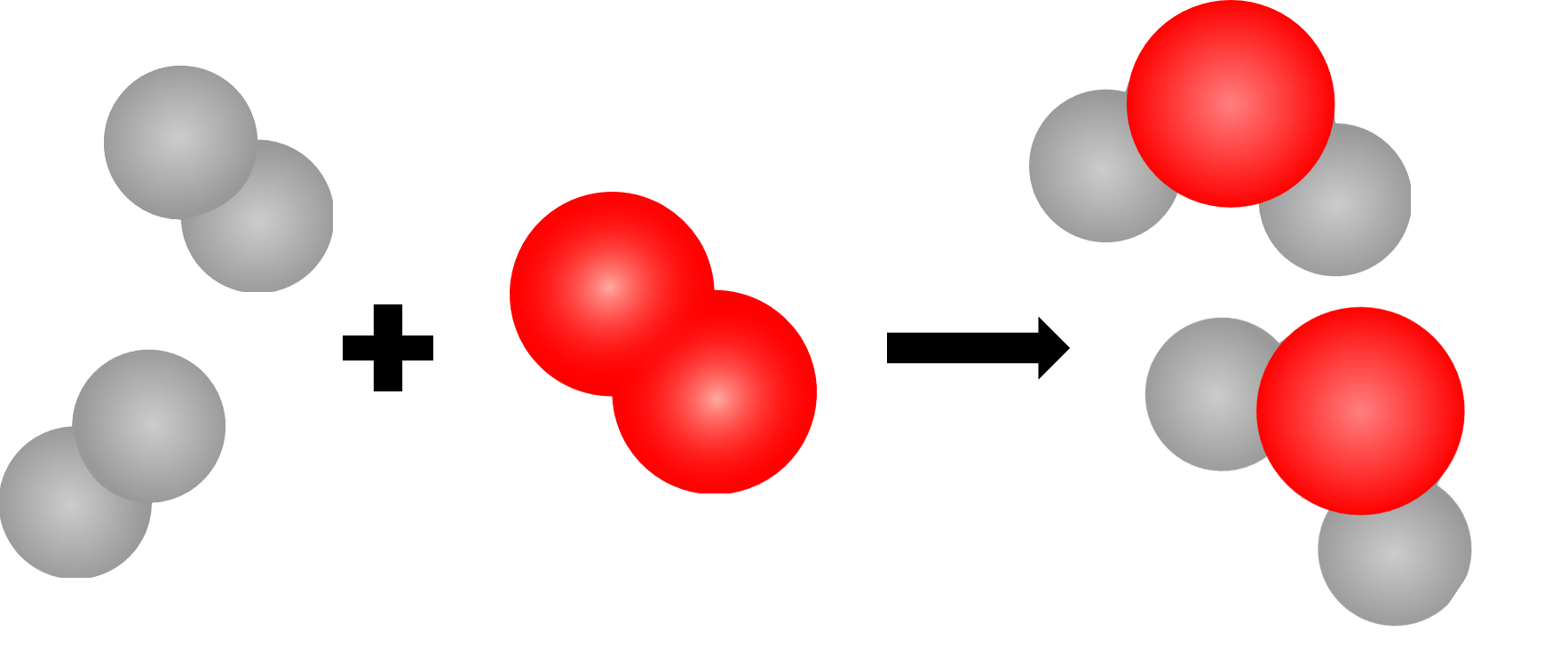
Der Stoff Sauerstoff Der Stoff Aluminiumoxid, entstanden aus Aluminium und Sauerstoff. Ausgangsstoffe und Reaktionsprodukte einer chemischen Reaktion 2 H2 + 2 H20 Wasserstoff und Sauerstoff reagieren zu Wasser. Nun zum Schrittschema, das am Beispiel folgender Reaktion erläutert wird: Aluminium reagiert mit Sauerstoff zu Aluminiumoxid Schritt 1.
Erklärung Reaktionsgleichung? (Chemie, Atom, Moleküle)
Verwende den unteren Rechner um chemische Gleichungen auszugleichen und die Art der Reaktion festzustellen. Ausgeglichene chemische Gleichungen. 2 Al + 2 H 3 PO 4 → 2 AlPO 4 + 3 H 2. chemische Reaktion . Aluminium + Phosphorsäure = Aluminiumorthophosphat + Molekularer Wasserstoff. Finde heraus welche Art von Reaktion aufgetreten ist.
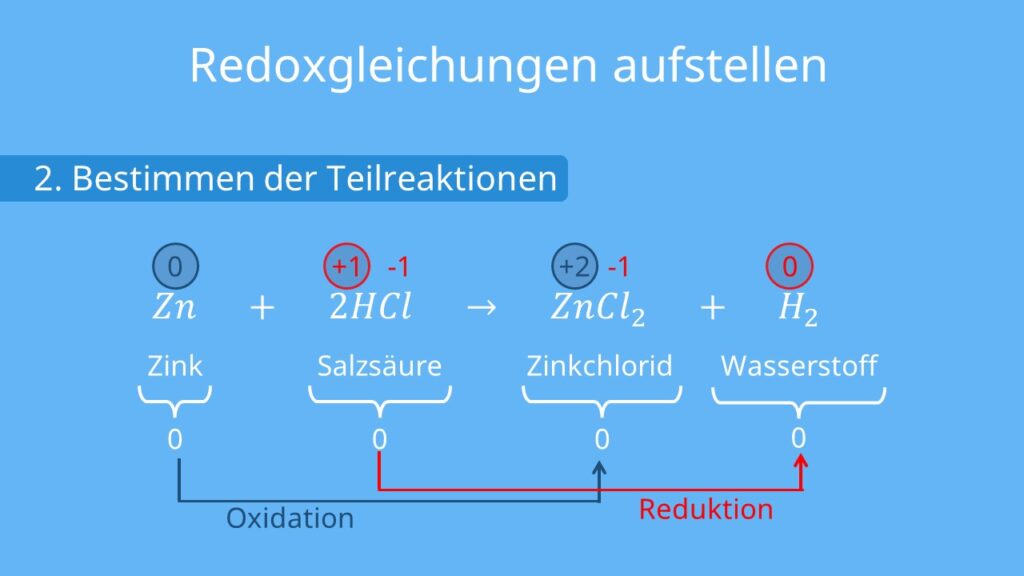
Redoxreaktionen · aufstellen und Beispiel (2023)

Eisen(III)-oxid gibt seinen Sauerstoff an Aluminium ab. Die Eisenionen werden dabei reduziert. Aluminium wird hingegen durch die Aufnahme von Sauerstoff oxidiert. Schauen wir uns jetzt die Teilgleichungen an. Hier kannst du anhand der Elektronenübergänge erkennen, welcher Stoff oxidiert bzw. reduziert wird. Die zwei Teilgleichungen sind:
Reaktion unedler Metalle mit sauren Lösungen / Säuren Chemie Endlich Verstehen YouTube

Beispielsaufgaben Redox-Reaktionen 1. Redoxreaktion und Teilchengleichung von Aluminium + Sauerstoff Oxidation: Al à Al3+ + 3e-| x 4 Reduktion: O 2 + 4e-à 2 O2-| x 3. 2 à 4 Al3+ + 6 O2-Reaktionsgleichung: 4 Al + 3 O 2 à 2 Al 2O 3 2. Oxidationszahlen von H 3PO 4 3. Beurteilen Sie, ob folgende 2 Stoffe miteinander reagieren: Quecksilber.
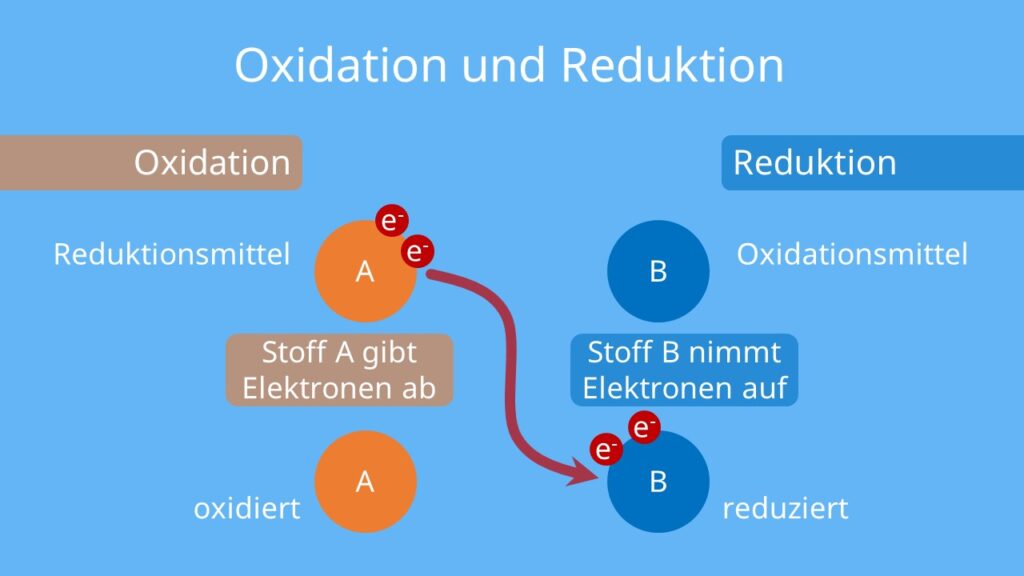
Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]
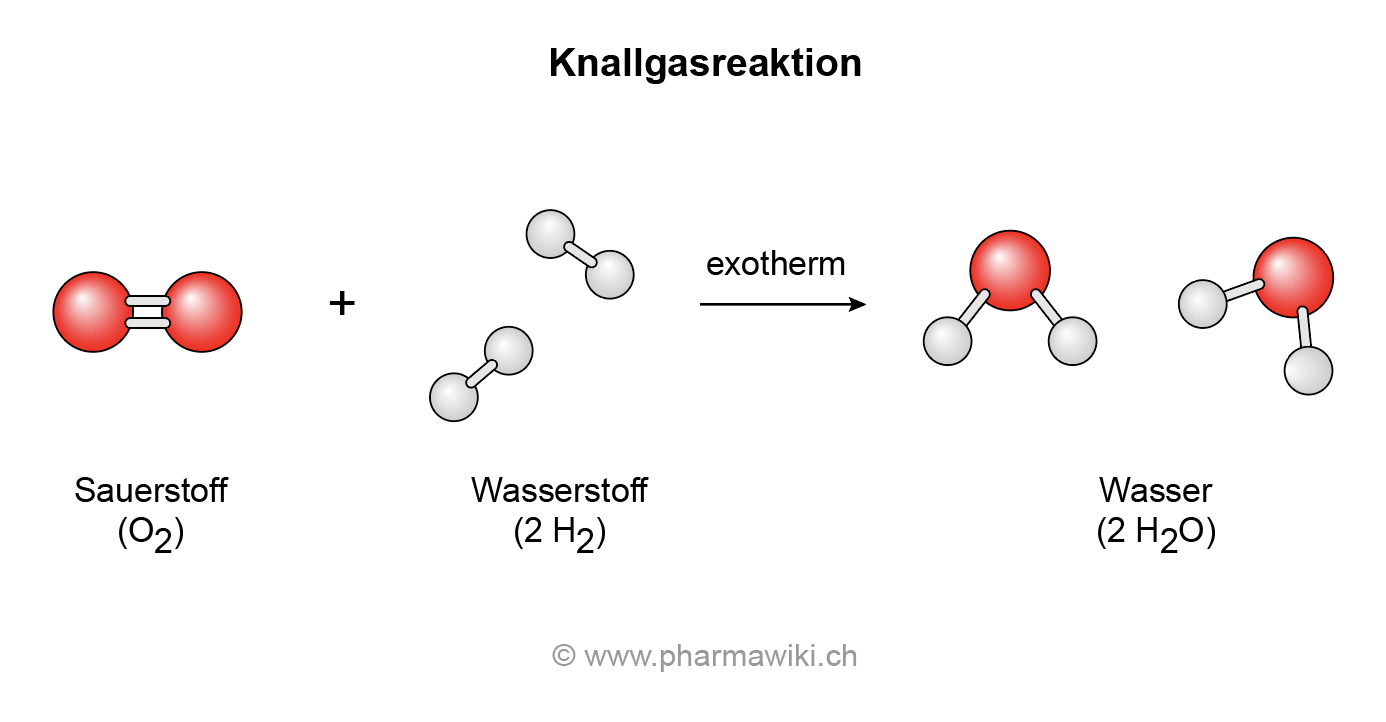
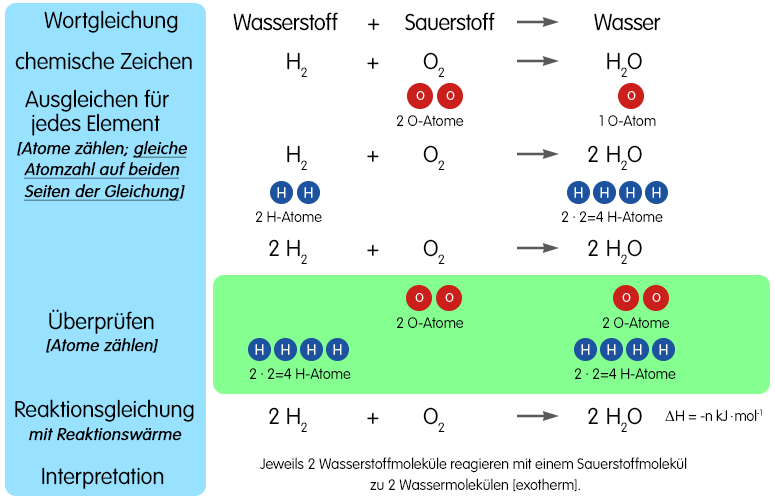
Der Pfeil gibt die Richtung der chemischen Reaktion an. Reaktionsgleichung: 2Cu + O 2 → 2CuO Aussage: 2 mol Kupfer reagieren mit 1 mol Sauerstoff zu 2 mol Kupfer(II)-oxid. Vertiefung von „3. Atomsorten zählen" und „5. Reaktionsgleichung ausgleichen" auf Seite 1 - Wie viele Atome sind gemeint? 2Cu 2 Kupferatome O 2 2 Sauerstoffatome
Redoxreaktionen · aufstellen und Beispiel · [mit Video]
Wortgleichung. Aluminium und Sauerstoff reagieren zu Aluminiumoxid. 2. Übersetzen der Wortgleichung in eine vorläufige Formelgleichung. Al + O2 ---> Al2O3. 3. Ausgleichen der vorläufigen Formelgleichung zur Reaktionsgleichung. 4 Al + 3 O2 ---> 2 Al2O3. Die Wortgleichung dient dir dafür, dass du alle Ausgangsstoffe (Edukte) und alle.
Übung Stelle die Reaktionsgleichung auf! ǀ Lernwerk TV

Da Aluminium Sauerstoff stärker bindet als Eisen, kann es auch als Reduktionsmittel für die Reduktion von Eisen(III)-oxid eingesetzt werden. Während der Reaktion nimmt das Aluminium Sauerstoff auf (Oxidation) und reagiert zum Aluminiumoxid.
Chemie redoxgleichungen? (Schule)

Die Reaktionsgleichungen im Hall-Héroult-Prozess. Das Aluminiumoxid liegt in der Schmelze dissoziiert als Aluminium- und Sauerstoff-Ionen vor: Die dreifach positiv geladenen Aluminium-Ionen wandern an die Kathode (Kohlenstoffauskleidung der Wanne), wo sie Elektronen aufnehmen und so zum elementaren Aluminium reduziert werden. Al 3 + + 3 e-→ Al
Chemie Kl. 8 + Redoxreaktionen + Unterwasserfackel + Magnesium reagiert mit Wasser YouTube

Redoxreaktionen als Aufnahme und Abgabe von Sauerstoff. Unter Oxidation verstand man früher einfach eine Verbrennung, bei der ein Element sich mit Sauerstoff verbindet.. Der Sauerstoff wird vom Eisenoxid auf das Aluminium übertragen. Solche Reaktionen heißen Redoxreaktionen, da ein Stoff reduziert und ein Stoff oxidiert wird. Reduktion.
.